Черный кремний стал еще чернее: Наука и техника: Lenta.ru
Голландским физикам удалось создать кремниевую поверхность, которая поглощает почти весь видимый свет (да еще и значительную часть инфракрасного спектра), который на нее падает. Поверхности такого рода известны достаточно давно под общим названием «черный кремний» — в этом смысле созданный голландцами кремний, конечно, самый черный из всех.
Самый черный кремний
Впервые термин «черный кремний» возник в работе 1990 года, вышедшей в журнале Journal of Vacuum Science & Technology. Изучая реактивное ионное травление кремниевой поверхности, исследователи обнаружили неожиданный факт — поверхность кремниевой подложки при травлении без какой либо маски (травление обычно используют при литографии, для получения на кремниевой поверхности нужного рисунка) заметно темнела. Изучив поверхность с помощью электронного микроскопа, ученые установили, что дело в данном случае не в банальном «химическом» изменении цвета, а в изменении оптических свойств поверхности на микроуровне.
Причина этого изменения кроется вот в чем. Суть метода реактивного ионного травления состоит в том, что вещество подложки удаляется в результате направленной обработки ионами активных веществ (в работе использовались ионы брома и хлора). Метод хорош, среди прочего, тем, что позволяет выбирать направление, в котором происходит удаление атомов с подложки, однако, удаление материала происходит неравномерно. Из-за этого на подложке образуется довольно сложный рисунок из впадин и столбов, образуемых продуктами реакции кремния с ионами.
![]()
Конусы на поверхности кремния. Фото SIOnyx
Lenta.ru
Почему конкретно образуется тот рельеф, который образуется — не очень понятно даже сейчас, спустя более чем два десятка лет после открытия. Физики говорят, что тут дело в естественных флуктуациях самого ионного потока и структуре подложки, однако подходящей модели, которая могла бы предсказывать возникающие структуры, у них нет. Кроме этого, неясно, почему обработанный таким образом кремний начинает так хорошо поглощать падающий на него свет — предполагается, что дело в многократном отражении, преломлении и рассеивании света.
Позже ученым удалось экспериментальным путем получать довольно регулярные структуры, представляющие собой по сути «лес» из конусов. Также с 90-х годов прошлого века было открыто еще несколько способов получения черного кремния. Например, кремниевую поверхность можно облучать лазерными импульсами продолжительностью в несколько фемтосекунд (10-15 секунды), термической обработкой и ультрафиолетовой литографией. Первый даже был запатентован группой из Гарварда, которая организовала фирму SIOnyx, в 2011 году получившую на развитие своей технологии от министерства обороны США 3 миллиона долларов. В общем, сейчас термин «черный кремний» применяется к целому классу кремниевых поверхностей.
В чем дело?
Черный кремний интересует ученых по многим причинам. Остановимся на трех основных направлениях применения этого материала.
Во-первых, черный кремний может, в теории, заметно увеличить эффективность солнечных батарей. Дело в том, что отражение света кремниевой подложкой батареи — это, в первую очередь, потеря энергии. В свою очередь, снижая долю отраженного света, можно увеличить количество производимой такой батареей энергии. Сейчас в батареях для этого используются разного рода антибликовые покрытия, которые, однако, уступают черному кремнию.
Другой областью применения (в этом направлении работает SIOnyx) является создание более эффективных, по сравнению с существующими моделями, полупроводниковых датчиков электромагнитного излучения (причем, не обязательно в видимом диапазоне). Развитие этой технологии в перспективе может позволить улучшить характеристики существующей техники без кардинальных изменений в процессе производства.
![]()
Конусы крупным планом. Масштаб 50 нанометров. Иллюстрация Kalem et al.
Lenta.ru
Еще одно, совершенно неожиданное применение черному кремнию нашли немецкие физики в 2008 году. Сначала они приготовили пластинку кремния, покрытую коническими наноиглами высотой 2 микрометра (иглы были получены с помощью все того же реактивного ионного травления). Оказалось, что при облучении пластинки лазерным лучом с одной стороны, противоположная сторона излучает в терагерцовом диапазоне (так называемые T-лучи).
Дело в том, что Т-лучи легко проникают сквозь бумагу, одежду, картон, пластмассу и многие другие материалы. Они могут применяться для обнаружения скрытого оружия или взрывчатки, диагностирования опухолей, поиска дефектов и трещин в материалах. Главным препятствием, однако, к их повсеместному внедрению является отсутствие соответствующих излучателей. Например, первый источник когерентного терагерцевого излучения (допуская вольность языка, такие источники называют Т-лазерами), работающий при комнатной температуре, был создан в 2008 году.
Самый черный лес
Новая работа голландских физиков по черному кремнию является логическим продолжением их предыдущих открытий. В 2011 году они установили, что металлические цилиндры нанометровых масштабов на кремниевой поверхности могут довольно хорошо поглощать свет. Эффект был связан с плазмонами — квазичастицами, представляющими собой квант колебания электронного газа, в частности, в металле.
В рамках новой работы ученые создали черный кремний, который представляет собой кремниевую поверхность, но уже с регулярно расставленными по ней кремниевыми цилиндрами. Для получения этой поверхности использовалось уже упоминавшееся реактивное ионное травление. Размеры цилиндров составляли 250 нанометров на 150 нанометров. Нанолес был залит слоем нитрида кремния Si3N4 толщиной в 60 нанометров.
Как оказалось, полученный таким образом материал отражает менее 2 процентов падающего на него света в видимом диапазоне (небольшой пик отражаемости наблюдался для длин волн 650 нанометров) при угле падения не меньше 60 градусов. По словам ученых, они провели сравнение полученного ими черного кремния с лучшими образцами антибликовых покрытий — в лучшем случае последние снижали долю отраженного света до 10 процентов.
Высокая эффективность поглощения объясняется тем, что часть излучения по цилиндрам «утекала» в подложку. На это указывает компьютерная модель черного кремния, в основу которой положена модифицированная теория рассеивания Ми (оригинальный вариант — это рассеивание плоской электромагнитной волны на однородной сфере). Примечательно, что ученые пробовали брать вместо цилиндров шары, однако, как оказалось, такая батарея работает заметно хуже.
Сами ученые надеются, что созданная ими технология позволит применять черный кремний на практике уже в самом ближайшем будущем. Впрочем, можно ли их метод использовать в промышленных масштабах, пока неизвестно.
Кремний — урок. Химия, 8–9 класс.
Химический элемент
Кремний — химический элемент № \(14\). Он расположен в IVА группе Периодической системы.
Si14+14)2e)8e)4e
На внешнем слое атома кремния содержатся четыре валентных электрона. До его завершения не хватает четырёх электронов. Поэтому в соединениях с металлами кремнию характерна степень окисления \(–4\), а при взаимодействии с более электроотрицательными неметаллами он проявляет положительные степени окисления \( +2\) или \(+4\).
По содержанию в земной коре кремний занимает второе место после кислорода. Земная кора более чем наполовину образована соединениями кремния. Распространены оксид кремния(IV) SiO2, силикаты и алюмосиликаты. Песок, кварц, горный хрусталь, аметист состоят из оксида. Гранит, полевой шпат, глина представляют собой силикаты и алюмосиликаты.
Входит кремний и в состав живых организмов. Его соединения придают прочность стеблям растений, содержатся в наружных покровах животных, образуют раковины и скелеты некоторых обитателей водной среды. У человека кремний присутствует в волосах и ногтях.

Скелеты радиолярий
Простое вещество
Кремний имеет атомную кристаллическую решётку, похожую на решётку алмаза. Каждый атом кремния в его кристаллах связан четырьмя ковалентными связями с соседними атомами. Благодаря такому строению у него высокая твёрдость.
Радиус атома кремния больше радиуса атома углерода, поэтому в его кристаллах электроны более свободны по сравнению с алмазом. Кремний проводит электрический ток, а его электропроводность увеличивается с повышением температуры или при освещении. Такие вещества относятся к полупроводникам.
В отличие от алмаза кремний представляет собой чёрно-серое непрозрачное вещество. У него высокая температура плавления (\(1428\) °С).
Кремний
Получают кремний восстановлением его оксида коксом в электропечах:
SiO2+2C=tSi+2CO↑.
Химические свойства
В химических реакциях кремний может проявлять и окислительные, и восстановительные свойства. Окислительные свойства кремния выражены слабее, чем у остальных неметаллов.
- Взаимодействие с металлами.
При высокой температуре кремний реагирует с металлами с образованием силицидов:
2Mg0+Si0=tMg+22Si−4.
В этой реакции кремний — окислитель.
- С водородом не реагирует.
С водородом кремний практически не реагирует по причине неустойчивости водородного соединения силана Sih5. Силан можно получить при гидролизе силицидов:
Mg2Si+4h3O=2Mg(OH)2↓+Sih5↑.
Он самовоспламеняется на воздухе и сгорает с образованием оксида кремния(\(IV\)) и воды:
Sih5+2O2=SiO2+2h3O.
- Взаимодействие с кислородом.
Кремний горит в кислороде и проявляет в этой реакции восстановительные свойства:
Si0+O02=tSi+4O−22.
- Взаимодействие с оксидами металлов.
Кремний способен восстанавливать некоторые металлы из их оксидов:
2Cu+2O+Si0=t2Cu0+Si+4O2.
- Взаимодействие со щелочами.
В отличие от углерода кремний растворяется в концентрированных растворах щелочей c образованием силикатов и выделением водорода:
Si+2NaOH+h3O=Na2SiO3+2h3↑.
Применение кремния
используется в производстве полупроводников для электронной промышленности;
применяется для изготовления солнечных батарей;
входит в состав жаропрочных и кислотоустойчивых сплавов.
Солнечные батареи
Кремний. Химия кремния и его соединений
1. Положение кремния в периодической системе химических элементов
2. Электронное строение кремния
3. Физические свойства и нахождение в природе кремния
4. Качественные реакции на силикаты
5. Основные соединения кремния
6. Способы получения кремния
7. Химические свойства кремния
7.1. Взаимодействие с простыми веществами
7.1.1. Взаимодействие с галогенами
7.1.2. Взаимодействие с серой и углеродом
7.1.3. Взаимодействие с водородом
7.1.4. Взаимодействие с азотом
7.1.5. Взаимодействие с активными металлами
7.1.6. Горение
7.2. Взаимодействие со сложными веществами
7.2.1. Взаимодействие с щелочами
7.2.2. Взаимодействие с кислотами
7.2.3. Взаимодействие с азотной кислотой
Бинарные соединения кремния — силициды, силан и др.
Оксид кремния (IV)
1. Физические свойства и нахождение в природе
2. Химические свойства
2.1. Взаимодействие с щелочами и основными оксидами
2.2. Взаимодействие с водой
2.3. Взаимодействие с карбонатами
2.4. Взаимодействие с кислотами
2.5. Взаимодействие с металлами
2.6. Взаимодействие с неметаллами
Кремниевая кислота
1. Строение молекулы и физические свойства
2. Способы получения
3. Химические свойства
Силикаты
Кремний
Положение в периодической системе химических элементов
Кремний расположен в главной подгруппе IV группы (или в 14 группе в современной форме ПСХЭ) и в третьем периоде периодической системы химических элементов Д.И. Менделеева.
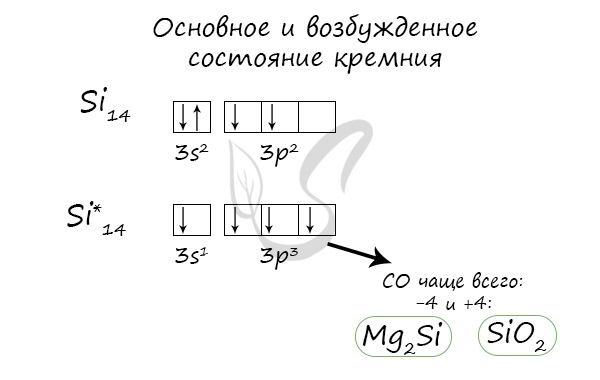
Электронное строение кремния
Электронная конфигурация кремния в основном состоянии:
+14Si 1s22s22p63s23p2 
Электронная конфигурация кремния в возбужденном состоянии:
+14Si* 1s22s22p63s13p3 
Атом кремния содержит на внешнем энергетическом уровне 2 неспаренных электрона и 1 неподеленную электронную пару в основном энергетическом состоянии и 4 неспаренных электрона в возбужденном энергетическом состоянии.
Степени окисления атома кремния — от -4 до +4. Характерные степени окисления -4, 0, +2, +4.
Физические свойства, способы получения и нахождение в природе кремния
Кремний — второй по распространенности элемент на Земле после кислорода. Встречается только в виде соединений. Оксид кремния SiO2 образует большое количество природных веществ – горный хрусталь, кварц, кремнезем.

Простое вещество кремний – атомный кристалл темно-серого цвета с металлическим блеском, довольно хрупок. Температура плавления 1415 °C, плотность 2,33 г/см3. Полупроводник.
Качественные реакции
Качественная реакция на силикат-ионы SiO32- — взаимодействие солей-силикатов с сильными кислотами. Кремниевая кислота – слабая. Она легко выделяется из растворов солей кремниевой кислоты при действии на них более сильными кислотами.
Например, если к раствору силиката натрия прилить сильно разбавленный раствор соляной кислоты, то кремниевая кислота выделится не в виде осадка, а в виде геля. Раствор помутнеет и «застынет».
Na2SiO3 + 2HCl = H2SiO3 + 2 NaCl

Видеоопыт взаимодействия силиката натрия с соляной кислоты (получение кремниевой кислоты) можно посмотреть здесь.
Соединения кремния
Основные степени окисления кремния +4, 0 и -4.
Наиболее типичные соединения кремния:
| Степень окисления | Типичные соединения |
| +4 | оксид кремния (IV) SiO2 кремниевая кислота H2SiO3 силикаты MeSiO3 бинарные соединения с неметаллами (карбид кремния SiC) |
| -4 | силан SiH4 силициды металлов (силицид натрия Na4Si) |
Способы получения кремния
В свободном состоянии кремний был получен Берцелиусом в 1822 г. Его латинское название «силиций» произошло от латинского слова «sileх», что означает «кремень». Аморфный кремний в лаборатории можно получить при прокаливании смеси металлического магния с диоксидом кремния. Для опыта диоксид кремния следует тщательно измельчить. При нагревании смеси начинается бурная реакция. Одним из продуктов этой реакции является аморфный кремний.
SiO2 + 2Mg → Si + 2MgO
Видеоопыт взаимодействия оксида кремния (IV) с магнием можно посмотреть здесь.
Еще один способ получения кремния в лаборатории — восстановление из оксида алюминием:
3SiO2 + 4Al → 3Si + 2Al2O3
В промышленности использовать дорогие алюминий и магний неэффективно, поэтому используют другие, более дешевые способы:
1. Восстановление из оксида коксом в электрических печах:
SiO2 + 2C → Si + 2CO
Однако в таком процессе процессе образующийся кремний загрязнен примесями карбидов кремния, и для производства, например, микросхем уже не подходит.
2. Наиболее чистый кремний получают восстановлением тетрахлорида кремния водородом при 1200 °С:
SiCl4 +2H2 → Si + 4HCl
или цинком:
SiCl4 + 2Zn → Si + 2ZnCl2
3. Также чистый кремний получается при разложении силана:
SiH4 → Si + 2H2
Химические свойства
При нормальных условиях кремний существует в виде атомного кристалла, поэтому химическая активность кремния крайне невысокая.
1. Кремний проявляет свойства окислителя (при взаимодействии с элементами, которые расположены ниже и левее в Периодической системе) и свойства восстановителя (при взаимодействии с элементами, расположенными выше и правее). Поэтому кремний реагирует и с металлами, и с неметаллами.
1.1. При обычных условиях кремний реагирует с фтором с образованием фторида кремния (IV):
Si + 2F2 → SiF4
При нагревании кремний реагирует с хлором, бромом, йодом:
Si + 2Cl2 → SiCl4
Si + 2Br2 → SiBr4
1.2. При сильном нагревании (около 2000оС) кремний реагирует с углеродом с образованием бинарного соединения карбида кремния (карборунда):
C + Si → SiC
При температуре выше 600°С взаимодействует с серой:
Si + 2S → SiS2
1.3. Кремний не взаимодействет с водородом.
1.4. С азотом кремний реагирует в очень жестких условиях:
3Si + 2N2 → Si3N4
1.5. В реакциях с активными металлами кремний проявляет свойства окислителя. При этом образуются силициды:
2Ca + Si → Ca2Si
Si + 2Mg → Mg2Si
1.6. При нагревании выше 400°С кремний взаимодействует с кислородом:
Si + O2 → SiO2
2. Кремний взаимодействует со сложными веществами:
2.1. В водных растворах щелочей кремний растворяется с образованием солей кремниевой кислоты. При этом щелочь окисляет кремний.
Si + 2NaOH + H2O → Na2SiO3 + 2H2
2.2. Кремний не взаимодействует с водными растворами кислот, но аморфный кремний растворяется в плавиковой кислоте с образованием гексафторкремниевой кислоты:
Si + 6HF → H2[SiF6] + 2H2
При обработке кремния безводным фтороводородом комплекс не образуется:
Si(тв.) + 4HF(г.) = SiF4 + 2H2
С хлороводородом кремний реагирует при 300 °С, с бромоводородом – при 500 °С.
2.3. Кремний растворяется в смеси концентрированных азотной и плавиковой кислот:
3Si + 4HNO3 + 12HF → 3SiF4 + 4NO + 8H2O
Бинарные соединения кремния
Силициды металлов
Силициды – это бинарные соединения кремния с металлами, в которых кремний имеет степень окисления -4. Химическая связь в силицидах металлов — ионная.
Силициды, как правило, легко гидролизуются в воде или в кислой среде.
Например, силицид магния разлагается водой на гидроксид магния и силан:
Mg2Si + 4H2O → 2Mg(OH)2 + SiH4
Соляная кислота легко разлагает силицид магния:
Mg2Si + 4HCl → 2MgCl2 + SiH4
Получают силициды сплавлением простых веществ или восстановлением смеси оксидов коксом в электропечах:
2Mg + Si → Mg2Si
2MgO + SiO2 + 4C → Mg2Si + 4CO
Силан
Силан – это бинарное соединение кремния с водородом SiH4, ядовитый бесцветный газ.
Если поместить порошок силицида магния в очень слабый раствор соляной кислоты, то на поверхности раствора образуются пузырьки газа. Они лопаются и загораются на воздухе. Это горит силан. Он образуется при взаимодействии кислоты с силицидом магния:
Mg2Si + 4HCl → 2MgCl2 + SiH4

Видеоопыт получения силана из силицида магния можно посмотреть здесь.
На воздухе силан горит с образованием SiO2 и H2O:
SiH4 + 2O2 → SiO2 + 2H2O
Видеоопыт сгорания силана можно посмотреть здесь.
Силан разлагается водой разлагается с выделением водорода:
SiH4 + 2H2O → SiO2 + 4H2
Силан разлагается (окисляется) щелочами:
SiH4 + 2NaOH + H2O → Na2SiO3 + 4H2
Силан при нагревании разлагается:
SiH4 → Si + 2H2
Карбид кремния
В соединениях кремния с неметаллами — ковалентная связь.
Рассмотрим карбид кремния – карборунд Si+4C-4. Это вещество с атомной кристаллической решеткой. Он имеет структуру, подобную структуре алмаза и характеризуется высокой твердостью и температурой плавления, а также высокой химической устойчивостью.
Карборунд окисляется кислородом при высокой температуре:
SiC +2O2 → SiO2 + CO2
Карборунд окисляется кислородом в расплаве щелочи:
SiC + 2O2 + 4NaOH → Na2SiO3 + Na2CO3 + 2H2O
Галогениды кремния
Хлорид и фторид кремния – галогенангидриды кремниевой кислоты.
SiCl4.
Получают галогениды кремния действием хлора на сплав оксида кремния с углем:
SiO2 + C + Cl2 → SiCl4 + CO
Галогениды кремния разлагаются водой до кремниевой кислоты и хлороводорода:
SiCl4 + 3H2O → H2SiO3↓ + 4HCl
Хлорид кремния (IV) восстанавливается водородом:
SiCl4 + 2H2 → Si + 4HCl
Оксид кремния (IV)
Физические свойства и нахождение в природе
Оксид кремния (IV) – это твердое вещество с атомной кристаллической решеткой. В природе встречается в виде кварца, речного песка, кремнезема и прочих модификаций:

Химические свойства
Оксид кремния (IV) – типичный кислотный оксид. За счет кремния со степенью окисления +4 проявляет слабые окислительные свойства.
1. Как кислотный оксид, диоксид кремния (IV) взаимодействует с растворами и расплавами щелочей и в расплаве с основными оксидами. При этом образуются силикаты.
Например, диоксид кремния взаимодействует с гидроксидом калия:
SiO2 + 2KOH → K2SiO3 + H2O
Еще пример: диоксид кремния взаимодействует с оксидом кальция.
SiO2 + CaO → CaSiO3
2. Оксид кремния (IV) не взаимодействует с водой, т.к. кремниевая кислота нерастворима.
3. Оксид кремния (IV) реагирует при сплавлении с карбонатами щелочных металлов. При этом работает правило: менее летучий оксид вытесняет более летучий оксид из солей при сплавлении.
Например, оксид кремния (IV) взаимодействует с карбонатом калия. При этом образуется силикат калия и углекислый газ:
SiO2 + K2CO3 → K2SiO3 + CO2
4. Из кислот диоксид кремния реагирует только с плавиковой или с газообразным фтороводородом:
SiO2 + 6HF(г) = SiF4 + H2O
SiO2 + 6HF(р-р) → H2[SiF6] + 2H2O
5. При температуре выше 1000 °С оксид кремния реагирует с активными металлами, при этом образуется кремний.
Например, оксид кремния взаимодействует с магнием с образованием кремния и оксида магния:
SiO2 + 2Mg → Si + 2MgO
Видеоопыт взаимодействия оксида кремния (IV) с магнием можно посмотреть здесь.
При избытке восстановителя образуются силициды:
SiO2 + 4Mg → Mg2Si + 2MgO
6. Оксид кремния (IV) взаимодействует с неметаллами.
Например, оксид кремния (IV) реагирует с водородом в жестких условиях. При этом оксид кремния проявляет окислительные свойства:
SiO2 + 2Н2 → Si + 2Н2O
Еще пример: оксид кремния взаимодействует с углеродом. При этом образуется карборунд и угарный газ:
SiO2 + 3С → SiС + 2СО
При сплавлении оксид кремния взаимодействует с фосфатом кальция и углем:
3SiO2 + Ca3(PO4)2 + 5C → 3CaSiO3 + 5CO + 2P
Кремниевая кислота
Строение молекулы и физические свойства
Кремниевые кислоты — очень слабые, малорастворимые в воде соединения общей формулы nSiO2•mH2O. Образует колоидный раствор в воде.

Метакремниевая H2SiO3 существует в растворе в виде полимера:

Способы получения
Кремниевая кислота образуется при действии сильных кислот на растворимые силикаты (силикаты щелочных металлов).
Например, при действии соляной кислоты на силикат натрия:
Na2SiO3 + 2HCl → H2SiO3 + 2 NaCl
Видеоопыт получения кремниевой кислоты из силиката натрия можно посмотреть здесь.
Даже слабая угольная кислота вытесняет кремниевую кислоту из солей:
Na2SiO3 + 2Н2O + 2CO2 → 2NaHCO3 + H2SiO3
Химические свойства
1. Кремниевая кислота — нерастворимая. Кислотные свойства выражены очень слабо, поэтому кислота реагирует только с сильными основаниями и их оксидами:
Например, кремниевая кислота реагирует с концентрированным гидркосидом калия:
H2SiO3 +4KOH → K2SiO3 + 4H2O
2. При нагревании кремниевая кислота разлагается на оксид и воду:
H2SiO3 → SiO2 + H2O
Силикаты
Силикаты — это соли кремниевой кислоты. Большинство силикатов нерастворимо в воде, кроме силикатов натрия и калия, их называют «жидким стеклом».
Способы получения силикатов:
1. Растворение кремния, кремниевой кислоты или оксида в щелочи:
H2SiO3 + 2KOH → K2SiO3 + 2H2O
Si + 2NaOH + H2O → Na2SiO3 + H2
SiO2 + 2KOH → K2SiO3 + H2O
2. Сплавление с основными оксидами:
СаО + SiO2 → CaSiO3
3. Взаимодействие растворимых силикатов с солями:
K2SiO3 + CaCl2 → CaSiO3 + 2KCl
Оконное стекло (натриевое стекло) — силикат натрия и кальция: Na2O·CaO·6SiO2.
Стекло получают при сплавлении в специальных печах смеси соды Na2CO3, известняка CaCO3 и белого песка SiO2:
6SiO2 + Na2CO3 + CaCO3 → Na2O·CaO·6SiO2 + 2CO2
Для получения специального стекла вводят различные добавки, так стекло содержащее ионы Pb2+ – хрусталь; Cr3+ – имеет зеленую окраску, Fe3+ – коричневое бутылочное стекло, Co2+ – дает синий цвет, Mn2+ – красновато-лиловый.
Кремний, подготовка к ЕГЭ по химии
Кремний — неметаллический элемент IVa группы периодической таблицы Д.И. Менделеева. Второй после кислород элемент по распространенности
в земной коре.
В чистом виде в природе практически отсутствует. Чаще всего встречается в виде кремнезема — SiO2 — песок, песчаник, кварц, глина.

Кремниевая (силиконовая) долина
Регион в штате Калифорния (США), отличающийся большой плотностью высоко технологичных компаний, связанных с производством
компьютеров и микропроцессоров.
Кремний является природным полупроводником, используется как основной материал для производства микросхем. Кремний ближе, чем
вы думаете: внутри гаджета, которым вы пользуетесь 😉

Основное и возбужденное состояние кремния
При возбуждении атома кремния электроны на s-подуровне распариваются и один из них переходит на p-подуровень.
Природные соединения
В природе кремний встречается в виде следующих соединений:
- SiO2 — кварц, кремнезем, гранит, песчаник, песок, глина
- SiO2 с примесью Fe3+ — цитрин
- SiO2 с примесью Fe2+ и Fe3+ — аметист

Получение
В промышленности кремний получают путем восстановления кремнезема в электрических печах, алюминотермией.
SiO2 + C → (t) Si + CO2↑
SiO2 + Al → (t) Si+ Al2O3
В лабораторных условиях мелкий белый песок прокаливают с магнием:
SiO2 + Mg → (t) MgO + Si
Химические свойства
- Реакции с неметаллами
- Реакции с металлами
- Реакция с щелочами
При обычных условиях без нагревания кремний реагирует только со фтором.
Si + F2 → SiF4
При нагревании кремний вступает в реакции с остальными галогенами (Cl, Br, I), углеродом, кислородом. При очень высоких температурах (1200 °C) кремний
с кислородом образует оксид кремния II — несолеобразующий оксид.
Si + Cl2 → (t) SiCl4
Si + C → (t) SiC
Si + O2 → (t) SiO2
Si + O2 → (t = 1200 °C) SiO

В подобных реакциях кремния проявляет свои окислительные способности.
Ca + Si → Ca2Si (силицид кальция)
С целью травления (удаления поверхностного слоя материала) кремниевые изделия можно погружать в раствор щелочи.
KOH + Si → K2SiO3 + H2↑
Оксид кремния IV — SiO2
Оксид кремния IV имеет атомное строение, обладает высокой прочностью и твердостью. Плавится при температуре
+1730 °C градусов.
Получение
В промышленности оксид кремния IV получают нагреванием кремния в атмосфере кислорода.
Si + O2 → SiO2
В лабораторных условиях проводят реакция силиката натрия с уксусной кислотой. Кремниевая кислота сразу же распадается на SiO2,
который выпадает в осадок, и воду.
Na2SiO3 + CH3COOH → CH3COONa + H2SiO3↓
H2SiO3 → SiO2 + H2O

Химические свойства
- Реакции с кислотами
- Реакции с основными оксидами и щелочами
- С карбонатами
Химически SiO2 устойчив к действию кислот, однако вступает в реакцию с газообразным фтороводородом (газом) и плавиковой кислотой (жидкостью).
SiO2 + HF → SiF4 + H2O
SiO2 является кислотным оксидом, соответствует кремниевой кислоте. Вступая в реакции с основными оксидами и щелочами, образует соли
данной кислоты — силикаты.
MgO + SiO2 → MgSiO3
NaOH + SiO2 → Na2SiO3 + H2O

Так как чаще всего кислотные оксиды с солями не реагируют, тем более необычной кажется реакция оксида кремния IV с карбонатами.
K2CO3 + SiO2 → K2SiO3 + CO2↑
Кремниевая кислота
Слабая, малорастворимая в воде кислота. Ее соли носят название — силикаты.
Получение
Поскольку кремниевая кислота малорастворима, то банальной реакцией SiO2 с водой ее не получить. Эту задачу решают в две стадии
через ее соли — силикаты.
LiOH + SiO2 → Li2SiO3 + H2O
Li2SiO3 + HCl → LiCl + H2SiO3↓
Химические свойства
Кремниевая кислота слабая, нестойкая, легко распадается на воду и оксид кремния IV.
H2SiO3 → H2O + SiO2

© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Имеет ли кремний запах — Портал о стройке

Кремний относится к самым распространенным минералам на Земле, входит в состав кремнеземов (кремень) и силикатов. Польза и вред кремниевой воды до сих пор вызывают дискуссии среди сторонников и противников ее применения. Спор о ее целебных свойствах возник после публикаций в конце семидесятых годов прошлого века. Хотя издавна в колодцах выкладывали на дно слой из кремния. Вода в них отличалась чистотой и приятным вкусом.
Содержание
Свойства минерала
Кремний, являющийся основой кремня, широко распространен на планете и используется людьми с первобытных времен. С его помощью добывали огонь, из него делали первые орудия труда. Антисептические свойства кремния также известны издавна. Кремний входит в состав известных камней, как яшма, агат, сердолик, относящихся к семейству кварцевых. Их основу составляет диоксид кремния, который называют кремнеземом. В чистом виде кремний был получен в девятнадцатом веке. Его название происходит от слова «гора» по-гречески.

Современная наука подтверждает антибактериальные свойства минерала. Кремний участвует в следующих биологических процессах в организме:
формирование ферментов, гормонов;
формирование коллагена;
- препятствует ожирению.
Кремний обнаружен в тканях щитовидной железы, лимфоузлов. Его антибактериальные свойства делают его незаменимым для поддержания иммунитета. Участвуя в строении коллагена, минерал входит в состав костной ткани, кожи, волосяного покрова и ногтей. Минерал участвует в усвоении других минералов и витаминов. Человеческий организм нуждается в потреблении кремния, количество которого должно составлять от пяти до пятидесяти миллиграмм в сутки. Часть кремния человек получает с пищей.
В природе много продуктов с повышенным содержанием кремния, таких как:
овсяные, рисовые отруби;
нерафинированный сахар;
полевой хвощ;
топинамбур;
смородина;
олива.
Но, несмотря на это, организм человека часто страдает от недостатка кремния, потому что ежедневно организм теряет его до девяти миллиграмм. Его недостаток имеет следующие проявления:

выпадение волос;
наблюдается хрупкость ногтей, зубов;
хрящи суставов быстро изнашиваются;
появляются признаки остеопороза;
отложение камней в почках, желчном пузыре;
развитие артрита, катаракты;
прогрессирует склероз сосудов.
Кремниевая вода — способ приготовления
Если поступление минерала с пищей недостаточно пополняет организм, то в качестве его источника используют кремниевую воду. Способ приготовления ее очень прост. Необходимы два компонента: чистая вода, желательно не из водопровода, и кремний. Кремний берут из расчета около десяти грамм на литр воды. Камень необходимо приобретать в аптеках, магазинах здоровья.

Перед первым использованием обрабатывают камни, выдержав их в растворе (1 чайная ложка кислоты на пол-литра воды) полчаса. Заливают кипящей водой. При дальнейшем использовании, если на камнях появляется белый налет, выдерживают в таком же растворе несколько часов. После ополаскивания минерал помещают в емкость (трехлитровую банку, пластиковую бутыль) и заливают чистой водой. Накрытую марлей посуду помещают в место без попадания прямых солнечных лучей. Спустя три дня кремниевая вода готова к употреблению. Можно настаивать семь–десять дней, чтобы получить насыщенный раствор.

Готовую воду рекомендуется перелить в другую посуду, а камни вымыть и просушить на солнце. Нельзя кипятить воду вместе с камнями, их необходимо предварительно извлечь. После использования кремния в течение шести–восьми месяцев, их необходимо заменить новыми, так как камни способны накапливать вредные вещества из воды. Готовую воду можно использовать для приготовления пищи, пить в сыром виде. Если поливать растения кремниевой водой, то улучшается их рост, ускоряется развитие.
Польза и вред кремниевой воды
Неоспоримо антибактериальное свойство воды, настоянной на кремнии. Наружное применение при умывании способно избавить от гнойничков на лице, юношеских прыщей. Полезно ополаскивать волосы для их укрепления и уничтожения перхоти. Применяют кремниевую воду для лечения и профилактики заболеваний горла, воспаления десен в качестве дополнительного средства лечения. Примочки с водой используют для лечения пролежней и трофических язв, дерматита.
Не утихают споры по поводу внутреннего применения кремниевой воды, ее пользы и вреда. Скептики советуют не увлекаться, ограничиваться приемом жидкости до двух стаканов в день. При заболеваниях, связанных с нарушением обмена в костной ткани и развитием остеопороза, переломах, полезно пить кремниевую воду. При болезнях печени и риске развития атеросклероза советуют принимать ее внутрь. Кремниевая вода является биологически активной, поэтому показана для укрепления иммунитета, снижения сахара, холестерина в крови, повышения гемоглобина.

Уже упоминали про использование кремниевой воды для полива растений, замачивания семян. Букет в вазе с активированной водой дольше не вянет. Полезно давать воду домашним любимцам, что способствует крепости зубов и костей, улучшает состояние шерсти и иммунитет.
Явных противопоказаний у воды, настоянной на кремнии, не обнаружено. Но, учитывая ее биологическую активность, применять ее вовнутрь следует с осторожностью. Противопоказаниями является наличие новообразований или наследственная склонность к ним, тромбозы, обострение сосудистых заболеваний. Поэтому не следует употреблять ее в больших количествах. А еще лучше проконсультироваться с лечащим врачом при наличии хронических болезней.
А вот по наружному применению кремниевой воды никаких ограничений не обнаружено. Поэтому можно смело умываться, ополаскивать голову и делать примочки и компрессы, промывать нос и полоскать горло. Покупать кремень следует только в аптеках и специализированных магазинах. Следует обратить внимание на цвет камня, который должен быть коричневого, но не черного цвета.
Source: PitanieInfo.ru
Читайте также
Новости: Запах кремния — Эксперт
Н
ет, это не похоже на CeBIT-party, тут все серьезно и официально. Место встречи — президиум Российской академии наук. Все три дня расписаны по минутам: 60 часов сессий и 24 часа лабораторных работ в восьми параллельных потоках. Воздух пропитан знаниями и новациями, от каждого человека веет незаурядным интеллектом. На стендах выставки доселе невиданные произведения мастеров Силиконовой долины: Intel и другие хвастают самым лучшим.
Одноядерные процессоры, то есть все те, что до последнего времени жили в наших персональных компьютерах, в своем развитии достигли предела. В то же время количество пользовательских задач и приложений, которые необходимо выполнять как можно быстрее, продолжает возрастать, даже самые современные системы порой не справляются с ними. Поэтому концепция параллелизма и аппаратной реализации многопоточности — основная перспектива развития общемировых инфокоммуникаций. Не вдаваясь в технические подробности, скажем, что этот подход позволит достичь значительного увеличения производительности (на 40–80%), существенно снизить энергопотребление (на 35–40%) и повысить функциональность системы, сохранив при этом потенциал роста.
Рассказ о многоядерности стал лейтмотивом в выступлении старшего вице-президента Intel, генерального директора подразделения Digital Enterprise Group Патрика Гелсингера — самого авторитетного сотрудника корпорации среди посетивших мероприятие в Москве. По его признанию, данная концепция не нова: первое открытое обсуждение прошло еще в 1989 году с его непосредственным участием. Исследования в этой области начались и того раньше. Сегодня в линейке Intel уже присутствуют порядка 15 моделей двухъядерных процессоров, и их число продолжает расти, а технология построения становится все более совершенной. Уже к концу 2006 года компания планирует довести долю многоядерных процессоров в объеме своих поставок до 70% для настольных и мобильных ПК и до 85% для серверов. К слову, корпорация Sun Microsystems также наладила серийный выпуск многоядерного процессора Ultra SPARC T1. Но тот больше ориентирован на исполнение серверных приложений и задач класса Web и широкому кругу пользователей недоступен.
В ближайшие год-полтора доля монгоядерных процессоров на рынке станет подавляющей
Второй, на наш взгляд наиболее значимой темой для обсуждений на форуме стало движение Всемирной паутины в сторону мобильности и персонализации. «Я был в России 30 лет назад, за это время здесь многое изменилось. Меняется и Интернет. Он эволюционирует сам и меняет нашу жизнь, сегодня он нужен всем. В ближайшее время Интернет вытеснит все остальные средства массовой информации», — предполагает Рама Шукла, вице-президент подразделения Mobility Group, директор подразделения Platform Program Office.
В настоящее время мы находимся на начальном этапе развития персонального Интернета. Пока все только зарождается, и на пути широкого распространения встречается ряд препятствий. Прежде всего это отсутствие возможности повсеместного использования высокоскоростных широкополосных каналов связи. Второе — низкая мобильность Интернета. Первая проблема решается достаточно просто, но поэтапно. В России темпы ее решения несколько ниже, чем в более развитых странах. Конечно же, речь идет о хот-спотах на базе технологий Wi-Fi и WiMAX. Бесспорно, второй стандарт более привлекателен, но, с другой стороны, даже в нашей стране точек доступа Wi-Fi уже достаточно много и отказываться от их использования нерационально. Поэтому инженеры Intel создали универсальное решение — миниатюрный микрочип Ofer, который содержит оба модуля радиосвязи на одной подложке. Он без проблем поместился бы в компактном мобильном телефоне. А пока большим шагом в развитии высокоинтеллектуальных подвижных систем стало появление ультрамобильных персональных компьютеров (UMPC). Это устройства с функционалом компьютера, доступом в Интернет, поддержкой различных сетевых подключений и возможностью адаптации в любом месте. Первые модели подобных систем производители Samsung, Asus и Founder продемонстрировали участникам форума.
Платформенный подход присутствует не только в мобильных решениях. «VPRO — профессиональная бизнес-платформа нового поколения перевернет всю отрасль, — заявил Патрик Гелсингер. — Она предполагает наивысшую степень безопасности и использует совершенно иной подход к ее обеспечению — защиту на уровне процессора». Платформа включает в себя технологии Active Management Technology и Virtualization Technology. Первая реализует аппаратную поддержку одновременной работы с несколькими программными средами на одной машине, что позволяет системным администраторам эффективно обслуживать сетевые компьютеры, не отбирая ресурсы у пользователей. Технология активного менеджмента в свою очередь обеспечивает возможность оперативной диагностики ПК даже в отключенном состоянии, а также позволяет мгновенно изолировать зараженный вирусом компьютер.
Наиболее интересный и необычный подход к автоматизации предприятий малого и среднего бизнеса показала компания «Аквариус». «Офис в коробке» — уникальное решение для российского рынка — включает в себя программно-аппаратный комплекс: до 50 персональных компьютеров, ноутбуки бухгалтера и руководителя с предустановленным ПО и персонифицированными настройками, а также набор сервисных услуг, оптимизированный для нужд небольших компаний. Пакет технической поддержки позволяет заказчику избежать дополнительных затрат при настройке системы и введении ее в эксплуатацию и сопровождении. Уже сейчас представленное решение пользуется большой популярностью среди покупателей.
Кремний / Хабр
Процессор? Песок? А какие у вас с этим словом ассоциации? А может Кремниевая долина?
Как бы там ни было, с кремнием мы сталкиваемся каждый день и если вам интересно узнать что такое Si и с чем его едят, прошу под кат.
Введение
Будучи студентом одного из московских вузов с специальностью «Наноматериалы», я хотел познакомить тебя, дорогой читатель, с самыми важными химическими элементами нашей планеты. Я долго выбирал с чего начать, углерод или кремний, и все таки решил остановиться именно на Si, потому что сердце любого современного гаджета основано именно на нем, если можно так выразиться конечно. Излагать мысли постараюсь предельно просто и доступно, написав этот материал я рассчитывал, в основном на новичков, но и более продвинутые люди смогут почерпнуть что-то интересное, так же хотелось бы сказать, что статья написана исключительно для расширения кругозора заинтересовавшихся. Итак, приступим.
Silicium
Кремний (лат. Silicium), Si, химический элемент IV группы периодической системы Менделеева; атомный номер 14, атомная масса 28,086.
В природе элемент представлен тремя стабильными изотопами: 28Si (92,27%), 29Si (4,68%) и 30Si (3,05%).
Плотность (при н.у.) 2,33 г/см³
Температура плавления 1688 K
Порошковый Si
Историческая справка
Соединения Кремния, широко распространенные на земле, были известны человеку с каменного века. Использование каменных орудий для труда и охоты продолжалось несколько тысячелетий. Применение соединений Кремния, связанное с их переработкой, — изготовление стекла — началось около 3000 лет до н. э. (в Древнем Египте). Раньше других известное соединение Кремния — оксид SiO2 (кремнезем). В 18 веке кремнезем считали простым телом и относили к «землям» (что и отражено в его названии). Сложность состава кремнезема установил И. Я. Берцелиус. Он же впервые, в 1825, получил элементарный Кремний из фтористого кремния SiF4, восстанавливая последний металлическим калием. Новому элементу было дано название «силиций» (от лат. silex — кремень). Русское название ввел Г. И. Гесс в 1834.
Кремний очень распространен в природе в составе обыкновенного песка
Распространение Кремния в природе
По распространенности в земной коре Кремний — второй (после кислорода) элемент, его среднее содержание в литосфере 29,5% (по массе). В земной коре Кремний играет такую же первостепенную роль, как углерод в животном и растительном мире. Для геохимии Кремния важна исключительно прочная связь его с кислородом. Около 12% литосферы составляет кремнезем SiO2 в форме минерала кварца и его разновидностей. 75% литосферы слагают различные силикаты и алюмосиликаты (полевые шпаты, слюды, амфиболы и т. д.). Общее число минералов, содержащих кремнезем, превышает 400.
Физические свойства Кремния
Думаю тут останавливаться особо не стоит, все физические свойства имеются в свободном доступе, а я же перечислю самые основные.
Температура кипения 2600 °С
Кремний прозрачен для длинноволновых ИК-лучей
Диэлектрическая проницаемость 11,7
Твердость Кремния по Моосу 7,0
Хотелось бы сказать, что кремний хрупкий материал, заметная пластическая деформация начинается при температуре выше 800°С.
Кремний — полупроводник, именно поэтому он находит большое применение. Электрические свойства кремния очень сильно зависят от примесей.
Химические свойства Кремния
Тут много конечно можно сказать, но остановлюсь на самом интересном. В соединениях Si (аналогично углероду) 4-валентен.
На воздухе кремний благодаря образованию защитной оксидной пленки устойчив даже при повышенных температурах. В кислороде окисляется начиная с 400 °С, образуя оксид кремния (IV) SiO2.
Кремний устойчив к кислотам и растворяется только в смеси азотной и фтористоводородной кислот, легко растворяется в горячих растворах щелочей с выделением водорода.
Кремний образует 2 группы кислородсодержащих силанов — силоксаны и силоксены. С азотом Кремний реагирует при температуре выше 1000 °С, Важное практическое значение имеет нитрид Si3N4, не окисляющийся на воздухе даже при 1200 °С, стойкий по отношению к кислотам (кроме азотной) и щелочам, а также к расплавленным металлам и шлакам, что делает его ценным материалом для химической промышленности, а так же для производства огнеупоров. Высокой твердостью, а также термической и химической стойкостью отличаются соединения Кремния с углеродом (карбид кремния SiC) и с бором (SiB3, SiB6, SiB12).
Получение Кремния
Я думаю это самая интересная часть, тут остановимся поподробнее.
В зависимости от предназначения различают:
1. Кремний электронного качества (т. н. «электронный кремний») — наиболее качественный кремний с содержанием кремния свыше 99,999 % по весу, удельное электрическое сопротивление кремния электронного качества может находиться в интервале примерно от 0,001 до 150 Ом•см, но при этом величина сопротивления должна быть обеспечена исключительно заданной примесью т. е. попадание в кристалл других примесей, хотя бы и обеспечивающих заданное удельное электрическое сопротивление, как правило, недопустимо.
2. Кремний солнечного качества (т. н. «солнечный кремний») — кремний с содержанием кремния свыше 99,99 % по весу, используемый для производства фотоэлектрических преобразователей (солнечных батарей).
3. Технический кремний — блоки кремния поликристаллической структуры, полученного методом карботермического восстановления из чистого кварцевого песка; содержит 98 % кремния, основная примесь — углерод, отличается высоким содержанием легирующих элементов — бора, фосфора, алюминия; в основном используется для получения поликристаллического кремния.
Кремний технической чистоты (95-98%) получают в электрической дуге восстановлением кремнезема SiO2 между графитовыми электродами. В связи с развитием полупроводниковой техники разработаны методы получения чистого и особо чистого кремния. Это требует предварительного синтеза чистейших исходных соединений кремния, из которых кремний извлекают путем восстановления или термического разложения.
Поликристаллический кремний («поликремний») — наиболее чистая форма промышленно производимого кремния — полуфабрикат, получаемый очисткой технического кремния хлоридными и фторидными методами и используемый для производства моно- и мультикристаллического кремния.
Традиционно поликристаллический кремний получают из технического кремния путём перевода его в летучие силаны (моносилан, хлорсиланы, фторсиланы) с последующими разделением образующихся силанов, ректификационной очисткой выбранного силана и восстановлением силана до металлического кремния.
Чистый полупроводниковый кремний получают в двух видах: поликристаллический (восстановлением SiCl4 или SiHCl3 цинком или водородом, термическим разложением SiI4 и Sih5) и монокристаллический (бестигельной зонной плавкой и «вытягиванием» монокристалла из расплавленного кремния — метод Чохральского).
Тут можно увидеть процесс выращивания кремния, методом Чохральского.
Метод Чохральского — метод выращивания кристаллов путём вытягивания их вверх от свободной поверхности большого объёма расплава с инициацией начала кристаллизации путём приведения затравочного кристалла (или нескольких кристаллов) заданной структуры и кристаллографической ориентации в контакт со свободной поверхностью расплава.
Применение Кремния
Специально легированный кремний широко применяется как материал для изготовления полупроводниковых приборов (транзисторы, термисторы, силовые выпрямители тока, тиристоры; солнечные фотоэлементы, используемые в космических кораблях, а так же много всякой всячины).
Поскольку кремний прозрачен для лучей с длиной волны от 1 до 9 мкм, его применяют в инфракрасной оптике.
Кремний имеет разнообразные и все расширяющиеся области применения. В металлургии Si
используется для удаления растворенного в расплавленных металлах кислорода (раскисления).
Кремний является составной частью большого числа сплавов железа и цветных металлов.
Обычно Кремний придает сплавам повышенную устойчивость к коррозии, улучшает их литейные свойства и повышает механическую прочность; однако при большем его содержании Кремний может вызвать хрупкость.
Наибольшее значение имеют железные, медные и алюминиевые сплавы, содержащие кремний.
Кремнезем перерабатываются стекольной, цементной, керамической, электротехнической и другими отраслями промышленности.
Сверхчистый кремний преимущественно используется для производства одиночных электронных приборов (например процессор твоего компьютера) и однокристальных микросхем.
Чистый кремний, отходы сверхчистого кремния, очищенный металлургический кремний в виде кристаллического кремния являются основным сырьевым материалом для солнечной энергетики.
Монокристаллический кремний — помимо электроники и солнечной энергетики используется для изготовления зеркал газовых лазеров.
Сверхчистый кремний и продукт его производства
Кремний в организме
Кремний в организме находится в виде различных соединений, участвующих главным образом в образовании твердых скелетных частей и тканей. Особенно много кремния могут накапливать некоторые морские растения (например, диатомовые водоросли) и животные (например, кремнероговые губки, радиолярии), образующие при отмирании на дне океана мощные отложения оксида кремния (IV). В холодных морях и озерах преобладают биогенные илы, обогащенные кремнием, в тропических морях — известковые илы с низким содержанием кремния. Среди наземных растений много кремния накапливают злаки, осоки, пальмы, хвощи. У позвоночных животных содержание оксида кремния (IV) в зольных веществах 0,1-0,5%. В наибольших количествах кремний обнаружен в плотной соединительной ткани, почках, поджелудочной железе. В суточном рационе человека содержится до 1 г кремния. При высоком содержании в воздухе пыли оксида кремния (IV) она попадает в легкие человека и вызывает заболевание — силикоз.
Заключение
Ну вот и все, если вы дочитали до конца и немного вникли, то вы на шаг ближе к успеху. Надеюсь писал я не зря и пост понравился хоть кому-то. Спасибо за внимание.
7 различных вагинальных запахов и почему они возникают
Да, мы тоже видели рекламу этих ароматизированных тампонов. И нам кажется, что весь этот цветочный солнечный свет — еще один пример того, как мир неправильно использует вагины.
Просто зайдите в местную аптеку. Вы найдете стену, полную продуктов, обещающих скрыть естественный запах влагалища. Как спринцевание. Широко признанный медицинским сообществом как вредный для естественного баланса влагалищной флоры, это распространенное средство, очищающее влагалище, на самом деле может вызвать бактериальный вагиноз.
В прошлом году в Интернете даже предложили использовать Vicks VapoRub в качестве средства для самостоятельного лечения запахов из влагалища.
По правде говоря, ваше влагалище является домом для миллиардов бактерий. И точный состав этих бактерий меняется ежедневно, а иногда и ежечасно.
Смена нормальная. Эти изменения запаха, скорее всего, являются результатом вашего менструального цикла, ваших гигиенических привычек или просто того, что вы сами.
Плюс, учитывая, что пах содержит скопление потовых желез, действительно ли удивительно, что ваше влагалище не без запаха?
Мы позвонили доктору.Мэри Джейн Минкин, имеющая более 30 лет опыта работы в области женского здоровья. Она помогла нам перейти к конкретным деталям со всей медицинской точностью, но без медицинского жаргона.
Вот ваш точный с медицинской точки зрения справочник по вагинальным запахам.
1. Острый или ферментированный
Очень часто влагалище издает острый или кислый аромат. Некоторые сравнивают это с запахом ферментированных продуктов. Фактически, йогурт, хлеб на закваске и даже немного кислого пива содержат тот же тип полезных бактерий, которые доминируют в большинстве здоровых влагалищ: Lactobacilli .
Если он пахнет удивительно похожим на тот кислый IPA, который вы ели на прошлых выходных, не волнуйтесь.
Причины резкого запаха
- Кислотность. pH здорового влагалища слабокислый, от 3,8 до 4,5. «Бактерии Lactobacilli поддерживают кислотность влагалища», — говорит Минкин. «Это защищает от чрезмерного роста вредных бактерий».
2. Медь, как пенни
Многие люди сообщают о медном металлическом вагинальном запахе.Обычно это не о чем беспокоиться. В редких случаях это означает более серьезную проблему.
Причины медного запаха
- Кровь. Кровь содержит железо с металлическим запахом. Самая частая причина крови — менструация. Во время менструации кровь и ткани выделяются из слизистой оболочки матки и проходят через вагинальный канал.
- Пол. Легкое кровотечение после секса может быть обычным явлением. Обычно это происходит из-за сухости влагалища или энергичного секса, который может вызвать небольшие порезы или царапины.Чтобы этого не произошло, попробуйте использовать смазку.
Медный запах также может быть следствием менее распространенных, но серьезных причин вагинального кровотечения. Металлический запах не должен сохраняться слишком долго после окончания менструации. Если ваше влагалище контактировало со спермой, это может изменить уровень pH и вызвать металлический запах.
Если вы испытываете кровотечение, не связанное с менструацией, или металлический запах продолжается с зудом и выделениями, лучше обратиться к врачу.
3. Сладкое, как патока
Когда мы говорим «сладкое», мы не имеем в виду свежеиспеченное печенье «сладкое».Мы имеем в виду крепкие и приземленные. Но не волнуйтесь, сладковатый оттенок не повод для беспокойства.
Причины сладкого запаха
- Бактерии . Ага, снова бактерии. PH вашего влагалища — это постоянно меняющаяся бактериальная экосистема. А иногда это означает, что вы можете почувствовать сладковатый запах.
4. Химические вещества, такие как недавно убранная ванная
Запах, похожий на запах отбеливателя или аммиака, может быть парой разных вещей. Иногда этот запах — повод обратиться к врачу.
Причины химического запаха
- Моча. Моча содержит побочный продукт — аммиак — мочевину. Скопление мочи в нижнем белье или вокруг вульвы может избавить от химического запаха. Имейте в виду, что моча с сильным запахом аммиака является признаком обезвоживания.
- Бактериальный вагиноз. Также возможно, что запах, похожий на химический, является признаком бактериального вагиноза. «Химический запах часто попадает в категорию рыбных», — говорит Минкин.
Бактериальный вагиноз — очень распространенная инфекция. Симптомы включают:
- неприятный или рыбный запах
- жидкие серые, белые или зеленые выделения
- вагинальный зуд
- жжение при мочеиспускании
5.Вкусный, как BO или копченый травяной, землистый аромат
Нет, это не только ты. Многие люди находят сходство между запахом тела и марихуаной. К сожалению, на этот вопрос нет хорошего научного ответа, хотя Vice предприняла попытку. Но благодаря потовым железам, расположенным внизу, мы, по крайней мере, знаем, почему запах влагалища и тела может быть таким похожим.
Причины неприятного запаха
- Эмоциональный стресс. Ваше тело содержит два типа потовых желез: апокринные и эккринные.Эккриновые железы производят пот, чтобы охладить ваше тело, а апокриновые железы реагируют на ваши эмоции. Эти апокриновые железы населяют ваши подмышки и, как вы уже догадались, пах.
Когда вы находитесь в состоянии стресса или беспокойства, апокринные железы выделяют жидкость молочного цвета. Сама по себе эта жидкость не имеет запаха. Но когда эта жидкость контактирует с множеством вагинальных бактерий на вашей вульве, она может производить резкий аромат.
6. Рыбное филе или то филе, о котором вы забыли
Вы, вероятно, слышали необычный запах из влагалища, описываемый как рыбный.На самом деле, свежая рыба вообще не должна сильно пахнуть. Разложение рыбы — более подходящее сравнение. Зачем? Триметиламин — химическое соединение, отвечающее как за отчетливый аромат гниющей рыбы, так и за некоторые аномальные вагинальные запахи.
Причины запаха мертвой рыбы
- Бактериальный вагиноз. «Бактериальный вагиноз возникает, когда во влагалище быстро разрастаются анаэробные бактерии», — говорит Минкин. «И эти анаэробные организмы пахнут».
- Трихомониаз. Трихомониаз — наиболее распространенная излечимая инфекция, передаваемая половым путем, которую легко лечить курсом антибиотиков. Он известен своим резким рыбным запахом. «Инфекция трихомониазом может иметь довольно неприятный запах», — говорит Минкин. «Это более выраженный рыбный запах, чем при бактериальном вагинозе».
В редких случаях рыбный запах свидетельствует о более серьезном заболевании.
7. Гнилой, как разлагающийся организм
Тухлый запах, от которого вздрагивает нос и морщится лицо, определенно не является нормой.Если запах гнилой, как от мертвого организма, это может быть не ваше влагалище, а что-то во влагалище.
Причины неприятного запаха
- Забытый тампон. Случайное попадание тампона во влагалище на несколько дней или даже недель — гораздо более частое явление, чем вы думаете. «Я не могу сказать, сколько тампонов я вынул у пациентов», — говорит Минкин. «Это случается со многими и многими людьми. Это не то, из-за чего тебе нужно стесняться.
К счастью, Минкин говорит, что самостоятельно удалить забытый тампон совершенно безопасно.
Когда вам следует обратиться к врачу
В общем, необычный запах должен быть легко обнаружен. От них у тебя морщится лицо. Гниющая рыба, мертвые организмы, гниль — все это неприятные запахи.
Если есть серьезная причина, часто наряду с запахом появляются другие симптомы.
Обратитесь к врачу, если запах сопровождается:
- зудом или жжением
- болью
- болью во время секса
- густыми творожными выделениями
- вагинальным кровотечением, не связанным с вашим периодом
Запах изменился, и это нормально
Незначительные сдвиги во влагалищном аромате — это нормально.Помните, запах влагалища напрямую зависит от его pH. И есть много вещей, которые влияют на ваш pH.
Возьмем, к примеру, вагинальный секс полового члена. У спермы относительно высокий pH, поэтому совершенно нормально заметить другой запах после вагинального секса с половым членом. Не волнуйтесь, это изменение временное.
Менопауза также влияет на pH влагалища. «Из-за нехватки эстрогена у женщин в период менопаузы уменьшается слизистая оболочка влагалища», — говорит Минкин.«Слизистая оболочка влагалища выстилает влагалище и питает бактерии Lactobacilli . Итак, без этих клеток вы можете получить гораздо более высокий pH ».
Наш совет? Не бойтесь по-настоящему узнать свое влагалище во всей его ароматной красоте. Чем лучше вы понимаете запахи, которые ваше влагалище производит изо дня в день, тем лучше вы будете подготовлены, когда что-то пойдет не так. В конце концов, вагины делают для нас так много замечательных вещей. Пора нам начать понимать, что они собой представляют.
Джинджер Войчик, помощник редактора Greatist. Следите за другими ее работами на Medium или подписывайтесь на нее в Twitter.
.
Как пахнет сперма? Причины различного запаха
Обычно у спермы слабый запах, вызываемый смесью химических веществ, таких как лимонная кислота и кальций. Сперма с необычным запахом, например с сильным рыбным запахом, может быть признаком инфекции.
Хотя сперма помогает сперматозоиду достигать яйцеклетки, сперма составляет только 1% спермы. Жидкости, составляющие остальные 99% спермы, придают ей запах. В этой статье мы обсудим, как обычно пахнет сперма и что может означать необычный запах.
Поделиться на PinterestЗапах спермы обычно слабый, потому что она в основном состоит из воды.
Сперма обычно пахнет веществами с таким же уровнем pH, который является мерой кислотности химического вещества.
Нормальная сперма слабощелочная, с pH от 7,2 до 7,8. Это такой же pH, что и в крови, и немного ниже, чем у морской воды и пищевой соды. Некоторые люди сообщают о более сильном запахе, напоминающем запах отбеливателя или нашатырного спирта, что является нормальным явлением.
Другие химические вещества, содержащиеся в сперме, также могут влиять на ее запах.Например, некоторые люди могут заметить сладкий запах, потому что сперма содержит фруктозу, сахар, содержащийся во фруктах. Сперма также содержит магний и кальций, которые придают ей легкий металлический или соленый запах.
Сперма в основном состоит из воды, поэтому запах обычно слабый. Некоторые люди могут даже не замечать запаха.
Запах спермы обычно меняется.
Сперма обычно имеет слабый запах, и изменение запаха может быть связано с изменением восприятия. Например, кто-то мог почувствовать более сладкий запах фруктозы в один раз и более соленый запах кальция в другой раз.
Продолжительные или значительные изменения запаха спермы могут указывать на основное заболевание, например инфекцию, передающуюся половым путем.
Некоторые запахи, которые могут указывать на проблему, включают:
- Очень сильный запах: Бактерии и другие микробы могут изменить запах спермы. Если сперма имеет неприятный и сильный запах или ухудшается со временем, это может быть признаком инфекции или заболевания, передающегося половым путем.
- Сладкий запах: Обычная сперма может пахнуть немного сладко из-за содержащейся в ней фруктозы.Но сперма с особенно сладким запахом может быть ранним признаком диабета. Одно старое исследование показывает, что у мужчин с диабетом в сперме может быть больше сахара, что придает ей более сладкий запах, чем обычно.
- Рыбный запах: Рыбный запах не является нормальным. Рыбный запах спермы может указывать на инфекцию, передающуюся половым путем.
Когда сперма меняет запах, она также может иметь другой вкус. Изменение вкусовых ощущений может быть еще одним признаком основного заболевания.
Запах спермы может измениться, если она смешается с другими веществами, такими как моча или пот.Кроме того, при высыхании он может пахнуть по-другому. Высушенная сперма имеет более сильный и заметный запах.
pH спермы может повлиять на ее запах, а если pH изменится, это может повлиять на запах. Простата также добавляет кислую жидкость в сперму, что снижает ее pH. Изменения функции простаты могут повлиять как на pH, так и на запах спермы.
Влагалище также слегка кисловатое. Когда сперма соединяется с вагинальными жидкостями, запах также может измениться.
В настоящее время нет качественных исследований, связывающих изменения в диете с устойчивыми изменениями вкуса или запаха спермы.Но так же, как еда может изменить запах пота или кожи человека, она также может временно изменить запах спермы.
Людям, которых беспокоит запах своей спермы, следует избегать продуктов с сильным запахом, таких как рыба. Им также следует избегать продуктов, которые меняют запах или цвет других жидкостей организма, например, спаржи.
Сперма у всех пахнет по-разному. Некоторые люди могут даже заметить, что запах меняется с течением времени или при изменении диеты, физических упражнений, отдыха и других факторов образа жизни.
Лучше обратиться к врачу, если:
- сперма внезапно пахнет неприятным запахом
- сперма пахнет очень сладко
- в сперме присутствует кровь
- эякуляция становится болезненной
- возникают проблемы с мочеиспусканием, такие как недержание мочи или частые поездки в туалет ночью
- гениталии становятся зудящими
- необычные выделения из полового члена
- появляются шишки на половых органах или вокруг них
Полезно обратить внимание на запах спермы.Исследование 2015 года показало, что pH спермы влияет на здоровье спермы, что может повлиять на фертильность.
Содействовать здоровью спермы и репродуктивному здоровью можно:
- придерживаясь здоровой, сбалансированной диеты
- избегая продуктов или добавок, которые утверждают, что улучшают запах или качество спермы
- избегают курения и используют легкие наркотики
- ограничивают употребление алкоголя.
- много упражнений
У спермы слабый запах, который варьируется от человека к человеку.
Продолжительные изменения запаха спермы могут быть признаком основного заболевания. Например, сильный неприятный запах или запах рыбы может быть признаком инфекции или заболевания, передающегося половым путем. При появлении этих изменений обратитесь к врачу.
Некоторые вещи могут изменить запах спермы, например, когда она смешивается с мочой. Однако диета не может изменить запах спермы на долгое время.
.
Вагина пахнет аммиаком: беременность и другие причины
У каждой вагины свой запах. Большинство женщин описывают это как мускусный или слегка кисловатый запах, что вполне нормально. Хотя большинство запахов из влагалища вызывается бактериями, иногда ваша моча также может влиять на запах.
Поначалу запах аммиака во влагалище может вызывать тревогу, но обычно в этом нет ничего серьезного. Продолжайте читать, чтобы узнать, что может быть причиной этого и как с этим справиться.
Прежде чем углубляться в возможные причины запаха аммиака во влагалище, важно понять, как и почему ваш организм производит аммиак.Ваша печень отвечает за расщепление белков. Аммиак, который является токсичным, является результатом этого процесса. Прежде чем покинуть печень, аммиак расщепляется на мочевину, которая гораздо менее токсична.
Мочевина попадает в ваш кровоток и попадает в почки, где она покидает ваше тело при мочеиспускании. Этот слабый запах аммиака, который часто встречается в моче, является результатом образования побочных продуктов аммиака в мочевине.
Бактериальный вагиноз
Ваше влагалище содержит хрупкий баланс хороших и вредных бактерий.Любое нарушение этого баланса может вызвать слишком много вредных бактерий, что приведет к инфекции, называемой бактериальным вагинозом. Центр контроля заболеваний сообщает, что бактериальный вагиноз является наиболее распространенной инфекцией влагалища у женщин в возрасте от 15 до 44 лет. Многие женщины с бактериальным вагинозом сообщают о том, что из влагалища исходит рыбный запах, но другие ощущают более химический запах, похожий на запах аммиака.
Дополнительные симптомы бактериального вагиноза включают:
- боль, зуд или жжение
- ощущение жжения при мочеиспускании
- жидкие водянистые выделения белого или серого цвета
- зуд на внешней стороне влагалища
Некоторые случаи бактериального вагиноз проходит самостоятельно, но другим необходимы антибиотики.Вы можете снизить риск бактериального вагиноза, если не будете спринцеваться, что может нарушить баланс хороших и вредных бактерий во влагалище. Кроме того, вы можете снизить риск бактериального вагиноза, постоянно используя презервативы.
Беременность
Многие женщины отмечают запах аммиака на ранних сроках беременности. Неясно, почему это происходит, но, скорее всего, это связано с изменением рациона питания или инфекцией.
Некоторые продукты, например спаржа, могут влиять на запах мочи.Во время беременности некоторые женщины начинают испытывать тягу к еде, которую обычно не едят. Врачи не совсем понимают, почему это происходит.
Если вы едите новую пищу, из-за которой ваша моча пахнет иначе, вы можете заметить, что запах сохраняется из-за засохшей мочи вокруг влагалища или нижнего белья. Обычно это не повод для беспокойства, но вы можете вести дневник питания, чтобы отследить, какая еда вызывает это.
Исследование 2014 года также показало, что беременные женщины сообщают об усилении обоняния в течение первого триместра.Это означает, что вы можете просто замечать обычный запах мочи.
В некоторых случаях необычный запах может быть результатом бактериального вагиноза. Хотя это обычно несерьезно у небеременных женщин, бактериальный вагиноз связан с преждевременными родами и низкой массой тела при рождении. Если вы беременны и заметили какие-либо симптомы бактериального вагиноза, немедленно обратитесь к врачу.
Обезвоживание
Ваша моча представляет собой смесь воды и отходов жизнедеятельности, включая мочевину.Когда ваше тело обезвожено, отходы в моче становятся более концентрированными. Это может привести к тому, что ваша моча будет иметь сильный запах аммиака, а также станет более темным. Когда эта моча высыхает на вашей коже или нижнем белье, вы можете почувствовать стойкий запах аммиака.
Другие симптомы обезвоживания включают:
- усталость
- головокружение
- повышенная жажда
- уменьшение мочеиспускания
Попробуйте пить больше воды в течение дня и посмотрите, исчезнет ли запах.Если другие симптомы обезвоживания проходят, но вы все еще чувствуете запах аммиака, обратитесь к врачу.
Пот
По данным клиники Кливленда, 99 процентов пота — это вода. Другой 1 процент состоит из других веществ, включая аммиак. Ваш пот выделяется через два типа потовых желез, называемых эккринными и апокриновыми железами. Апокриновые железы чаще встречаются в областях с большим количеством волосяных фолликулов, включая пах.
В то время как пот обоих типов желез не имеет запаха, пот апокриновых желез имеет больше запаха при контакте с бактериями на коже.Помимо всех этих апокриновых желез, ваш пах содержит множество бактерий, что делает его идеальной средой для запахов, в том числе запаха аммиака.
Потоотделение и бактерии являются важными составляющими вашего общего здоровья, но вы можете ограничить создаваемый ими запах:
- тщательно промойте вульву теплой водой, уделяя особое внимание складкам на половых губах.
- носите белье из 100% хлопка. , которая облегчает испарение пота с вашего тела
- избегайте тесных штанов, которые затрудняют испарение пота с вашего тела
Менопауза
После менопаузы у многих женщин развивается постменопаузальный атрофический вагинит.Это приводит к истончению стенки влагалища, а также к воспалению. Это может сделать вас предрасположенным к недержанию мочи, в результате чего область вокруг влагалища может пахнуть аммиаком. Это также увеличивает риск развития вагинальных инфекций, таких как бактериальный вагиноз.
Другие симптомы постменопаузального атрофического вагинита включают:
- сухость
- ощущение жжения
- снижение смазки во время секса
- боль во время секса
- зуд
Некоторые симптомы можно легко контролировать с помощью натуральной смазки на водной основе .Вы также можете спросить своего врача о заместительной гормональной терапии. Между тем, ношение ежедневных прокладок поможет абсорбировать любые утечки мочи в течение дня.
.Кремний
| Свойства, использование, символ и факты
Кремний (Si) , неметаллический химический элемент семейства углерода (группа 14 [IVa] периодической таблицы). Кремний составляет 27,7% земной коры; это второй по распространенности элемент в коре, уступающий только кислороду.
Encyclopædia Britannica, Inc.
Британская викторина
118 Названия и символы из таблицы Менделеева
Ар
Название silicis происходит от латинского слова silic или silicis , что означает «кремень» или «твердый камень».Аморфный элементарный кремний был впервые выделен и описан как элемент в 1824 году шведским химиком Йенсом Якобом Берцелиусом. Загрязненный кремний был получен уже в 1811 году. Кристаллический элементарный кремний не был получен до 1854 года, когда он был получен как продукт электролиза. Однако в форме горного хрусталя кремний был знаком египтянам додинастического периода, которые использовали его для изготовления бус и небольших ваз; ранним китайцам; и, вероятно, многим другим древним. Изготовлением стекла, содержащего кремнезем, занимались как египтяне — по крайней мере, еще в 1500 г. до н. Э. — так и финикийцы.Конечно, многие из встречающихся в природе соединений, называемых силикатами, использовались в различных видах строительного раствора для строительства жилищ древними людьми.
| атомный номер | 14 |
|---|---|
| атомный вес | 28.086 |
| точка плавления | 1410 ° C (2570 ° F) |
| точка кипения | 2355 ° C (4270 ° F) |
| плотность | 2.33 г / см 3 |
| степень окисления | −4, (+2), +4 |
| электронная конфигурация | 1 с 2 2 с 2 2 p 6 3 с 2 3 p 2 |
Возникновение и распространение
По весу содержание кремния в земной коре превышает только кислород. Оценки космического содержания других элементов часто приводятся в терминах числа их атомов на 10 6 атомов кремния.Только водород, гелий, кислород, неон, азот и углерод превосходят кремний по количеству в космосе. Кремний считается космическим продуктом поглощения альфа-частиц при температуре около 10 9 К ядрами углерода-12, кислорода-16 и неона-20. Энергия, связывающая частицы, образующие ядро кремния, составляет около 8,4 миллиона электрон-вольт (МэВ) на нуклон (протон или нейтрон). По сравнению с максимумом около 8,7 миллионов электрон-вольт для ядра железа, почти вдвое более массивного, чем у кремния, эта цифра указывает на относительную стабильность ядра кремния.
Чистый кремний слишком реакционноспособен, чтобы его можно было найти в природе, но он содержится практически во всех породах, а также в песках, глинах и почвах в сочетании либо с кислородом в виде кремнезема (SiO 2 , диоксид кремния), либо с кислородом и другие элементы (например, алюминий, магний, кальций, натрий, калий или железо) в виде силикатов. Окисленная форма, такая как диоксид кремния и особенно силикаты, также распространена в земной коре и является важным компонентом мантии Земли. Его соединения также встречаются во всех природных водах, в атмосфере (в виде кремнистой пыли), во многих растениях, а также в скелетах, тканях и жидкостях тела некоторых животных.
Britannica Premium: удовлетворение растущих потребностей искателей знаний. Получите 30% подписки сегодня.
Подпишись сейчас
В составе соединений диоксид кремния встречается как в кристаллических минералах (например, кварц, кристобалит, тридимит), так и в аморфных или кажущихся аморфными минералах (например, агат, опал, халцедон) на всех участках суши. Природные силикаты характеризуются своим обилием, широким распространением, сложностью структуры и состава. Большинство элементов следующих групп периодической таблицы содержится в силикатных минералах: группы 1–6, 13 и 17 (I – IIIa, IIIb – VIb, VIIa).Эти элементы называют литофильными или любящими камни. Важные силикатные минералы включают глины, полевой шпат, оливин, пироксен, амфиболы, слюды и цеолиты.
Свойства элемента
Элементарный кремний производят в промышленных масштабах путем восстановления диоксида кремния (SiO 2 ) с помощью кокса в электрической печи, а затем очищают нечистый продукт. В небольших масштабах кремний можно получить из оксида восстановлением алюминием. Практически чистый кремний получают восстановлением тетрахлорида кремния или трихлорсилана.Для использования в электронных устройствах монокристаллы выращивают путем медленного извлечения затравочных кристаллов из расплавленного кремния.
Чистый кремний — твердое темно-серое вещество с металлическим блеском и октаэдрической кристаллической структурой, такой же, как у алмазной формы углерода, с которой кремний имеет много химического и физического сходства. Пониженная энергия связи в кристаллическом кремнии делает этот элемент более мягким и химически более активным, чем алмаз. Была описана коричневая порошкообразная аморфная форма кремния, которая также имеет микрокристаллическую структуру.
Поскольку кремний образует цепи, подобные тем, что образованы углеродом, кремний был изучен как возможный основной элемент для кремниевых организмов. Однако ограниченное количество атомов кремния, которые могут катенировать, значительно сокращает количество и разнообразие соединений кремния по сравнению с соединениями углерода. Окислительно-восстановительные реакции не являются обратимыми при обычных температурах. В водных системах стабильны только степени окисления кремния 0 и +4.
Кремний, как и углерод, относительно неактивен при обычных температурах; но при нагревании он активно реагирует с галогенами (фтором, хлором, бромом и йодом) с образованием галогенидов и с некоторыми металлами с образованием силицидов.Как и в случае с углеродом, связи в элементарном кремнии достаточно сильны, чтобы требовать больших энергий для активации или ускорения реакции в кислой среде, поэтому на него не действуют кислоты, за исключением фтористоводородной. При нагревании красным светом кремний подвергается воздействию водяного пара или кислорода, образуя поверхностный слой диоксида кремния. Когда кремний и углерод объединяются при температурах электропечи (2 000–2 600 ° C [3 600–4 700 ° F]), они образуют карбид кремния (карборунд, SiC), который является важным абразивом. С водородом кремний образует серию гидридов, силанов.В сочетании с углеводородными группами кремний образует серию органических соединений кремния.
Известны три стабильных изотопа кремния: кремний-28, который составляет 92,21% элемента в природе; кремний-29 4,70%; и кремний-30 3,09%. Известно пять радиоактивных изотопов.
Элементарный кремний и большинство кремнийсодержащих соединений не токсичны. Действительно, ткани человека часто содержат от 6 до 90 миллиграммов кремнезема (SiO 2 ) на 100 граммов сухого веса, а многие растения и низшие формы жизни усваивают кремнезем и используют его в своих структурах.Однако вдыхание пыли, содержащей альфа SiO 2 , вызывает серьезное заболевание легких, называемое силикозом, которое часто встречается у шахтеров, каменотесов и керамистов, если не используются защитные устройства.
.
